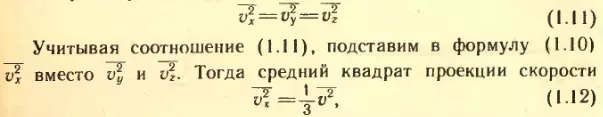| Главная » Файлы » Дистанционное обучение » Системный администратор 1 курс |
| 01.11.2020, 17:37 | |
"Основные положения молекулярно-кинетической теории. Строение газообразных, жидких и твердых тел. Идеальный газ" МКТ – это учение о строении и свойствах вещества. Молекулярная физика занимается изучением строения и свойств веществ, а так же процессами, происходящими в нем. В основе молекулярно-кинетической теории лежат три положения (опыт доказывающий каждое положение можно просмотреть пройдя по ссылке): 1) Вещество имеет дискретное строение, т. е. состоит из микроскопических частиц (https://www.youtube.com/watch?v=9ZO4ZB8cuk0&ab_channel=TVSmeshariki). 2) Частицы вещества хаотически движутся (броуновское движение опыт). 3) Частицы вещества взаимодействуют между собой (https://www.youtube.com/watch?v=NhPo6O1ofc8&ab_channel=GalileoRU). Силы взаимодействия между частицами вещества имеют электромагнитную природу и очень быстро убывают с увеличением расстояния между частицами. 4)Молекулы разделены промежутками (об этом свидетельствует наличие разных агрегатных состояний у различных тел). Основы МКТ на языке формулДля определения строения веществ оперируют такими понятиями, как относительная молекулярная и молярная массы, количество вещества. Относительная молекулярная (или атомная) масса веществаОтносительная молекулярная масса (Mr) показывает во сколько раз масса искомого атома или молекулы отличается от одной двенадцатой части массы атома углерода.
m0 – масса молекулы (или атома) данного вещества [кг], m0С – масса атома углерода [кг]. *Относительные атомные массы всех веществ указаны в периодической таблице Д.И. Менделеева. Количество веществаКоличество вещества (ν) - отношение числа частиц в данном ограниченном пространстве к числу молекул в одном моле вещества. Моль - это количество вещества, состоящее из такого же количества структурных единиц, какое содержится в 12 граммах углерода (С12).
Единицы измерения ν = [моль]. N – число частиц (молекул) в данном ограниченном теле (безразмерная величина); NA – число молекул в одном моле вещества (постоянная Авогадро) [моль-1]. NA = 6,02 · 1023 моль-1 – постоянная Авогадро.
Из-за неудобства работы с числом частиц количество вещества часто выражают также через молярную массу:
где m – масса любого количества вещества [кг], μ – молярная масса [кг · моль-1]. Молярная массаМолярная масса (μ) показывает массу одного моля вещества.
Единица измерения μ = [кг · моль-1]. Связь молярной и относительной молекулярной массы
Относительная молекулярная масса примерно в тысячу раз больше молярной. Агрегатные состояния веществаАгрегатное состояние — это состояние вещества, которое зависит от температуры и давления. В природе вещества встречаются в трёх агрегатных состояниях: твёрдом, жидком и газообразном. Вещество, находящееся при стандартных условиях в твёрдом состоянии, называется твёрдым веществом, в жидком состоянии — жидким веществом или жидкостью, в газообразном — газообразным веществом или газом. При одинаковых условиях (температуре и давлении) различные вещества могут находиться в разных агрегатных состояниях. Пример. В стандартных условиях:
Переходы между агрегатными состояниями:Многие вещества при изменении условий могут переходить из одного агрегатного состояния в другое. Пример. При температуре ниже 0 °C вода превращается в лёд, т. е. переходит из жидкого состояния в твёрдое. Переход вещества из газообразного состояния в жидкое называется конденсацией. Переход вещества из жидкого состояния в газообразное называется испарением. При увеличении температуры вещества испарение становится интенсивнее. И, наконец, при определённой температуре испарение становится настолько интенсивным, что жидкость закипает. Такая температура называется температурой кипения вещества. Испарение и кипение — это два способа перехода жидкости в газообразное состояние. Испарение происходит с поверхности жидкости, а при кипении жидкость переходит в газообразное состояние, как с поверхности, так и внутри неё. Когда говорят о веществах в газообразном состоянии, иногда помимо термина газ используется и слово пар. Газ и пар очень похожи между собой. Они представляют собой разновидности газообразного состояния вещества. Разница между газом и паром в том, что газ имеет температуру выше критической или равную ей, а пар — ниже. Пример. Критическая температура воды равна примерно 374 °C. Вода в газообразном состоянии, которая имеет температуру ниже критической, например, 5 °C или 120 °С, будет именно паром, а не газом. А вот, например, кислород, гелий и азот – газы, так как они имеют температуру выше критической (у каждого из них критическая температура ниже -100 °C). В быту под словом пар обычно подразумевают именно водяной пар. Переход вещества из жидкого состояния в твёрдое называется кристаллизацией. Переход вещества из твёрдого состояния в жидкое называется плавлением. Переход вещества из твёрдого состояния сразу в газообразное называется возгонкой или сублимацией. Переход из газообразного состояния в твёрдое называется десублимацией. При всех этих явлениях частицы вещества не разрушаются. Таким образом, вещество, изменяя агрегатное состояние, не превращается в другое вещество. Одни вещества могут иметь любое из трёх агрегатных состояний, другие — нет. Пример. Вода может находиться в твёрдом состоянии (лёд), жидком (вода) и газообразном (водяной пар). Для сахара известны только два агрегатных состояния: твёрдое и жидкое. При нагревании сахар плавится, затем его расплав темнеет, и появляется неприятный запах. Это свидетельствует о превращении сахара в другие вещества. Значит, газообразного состояния для сахара не существует. Взаимные переходы веществ из одного агрегатного состояния в другое в виде схемы:
Идеальный газ Идеальный газ. Идеальный газ с точки зрения молекулярно-кинетической теории простейшая физическая модель реального газа. Под моделью в физике понимают не увеличенную или уменьшенную копию реального объекта. Физическая модель – это создаваемая учеными общая картина реальной системы или явления, которая отражает наиболее существенные, наиболее характерные свойства системы. В физической модели газа принимаются во внимание лишь те основные свойства молекул, учет которых необходим для объяснения главных закономерностей поведения реального газа в определенных интервалах давления и температуры. В молекулярно-кинетической теории идеальным газом называют газ, состоящий из молекул, взаимодействие между которыми пренебрежимо мало. Иными словами, предполагается, что средняя кинетическая энергия молекул идеального газа во много раз больше потенциальной энергии их взаимодействия. Реальные газы ведут себя подобно идеальному газу при достаточно больших разрежениях, т. е. когда среднее расстояние между молекулами во много раз больше их размеров. В этом случае силами притяжения между молекулами можно полностью пренебречь. Силы же отталкивания проявляются лишь на ничтожно малых интервалах времени при столкновениях молекул друг с другом. В простейшей модели газа молекулы рассматривают как очень маленькие твердые шарики, обладающие массой. Движение отдельных молекул подчиняется законам механики Ньютона. Конечно, нет никакой гарантии, что с помощью такой модели можно объяснить все процессы в разреженных газах. Ведь известно, что молекулы отличаются не только массами. Они имеют сложное строение. Но сейчас мы поставим и будем решать достаточно узкую задачу: вычислим давление газа с помощью молекулярно-кинетической теории. Для этой задачи простейшая модель газа оказывается удовлетворительной. Она приводит к результатам, которые подтверждаются опытом. Давление газа в молекулярно-кинетической теории. Пусть газ находится в закрытом сосуде. Манометр показывает давление газа p0. (Напомним: давление определяется отношением модуля F силы, действующей перпендикулярно поверхности, к площади поверхности S: 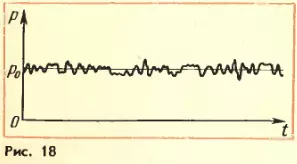
Давление газа будет тем больше, чем больше молекул ударяется о стенку за некоторый интервал времени и чем больше скорости соударяющихся со стенкой молекул. 
Тепловое движение молекул. С самого начала нужно отказаться от попыток проследить за движением всех молекул, из которых состоит газ. Их слишком много, и из-за столкновений друг с другом они движутся очень сложно. Нам и не нужно знать, как движется каждая молекула. Мы должны выяснить, к какому результату приводит совокупное движение всех молекул.
Характер же движения всей совокупности молекул газа известен из опыта (см. § З). Молекулы участвуют в хаотическом (тепловом) движении. Это означает, что скорость любой молекулы может оказаться как очень большой, так и очень малой, а направление движении молекул беспрестанно меняется при их столкновениям друг с другом. Скорости отдельных молекул могут быть любыми, однако среднее значение модуля их скорости вполне определенное. Точно так же рост учеников в классе не одинаков. Но среднее значение роста – определенная величина. Чтобы ее найти, надо сложить вместе рост учеников и разделить эту сумму на количество учеников. Среднее значение квадрата модуля скорости. В дальнейшем нам понадобится среднее значение не самой скорости, а квадрата скорости, от которого зависит средняя кинетическая энергия молекул. Обозначим модули скоростей отдельных молекул через v1, v2, v3, …, vN. Среднее значение квадрата скорости определится следующей формулой:  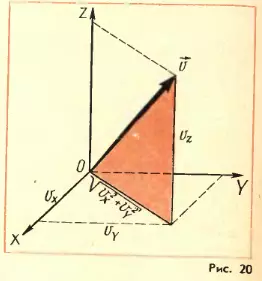
Действительно, для каждой молекулы справедливо выражение (1.9). Сложив эти выражения для отдельных молекул и разделив обе части полученного уравнения на число молекул N, мы придем к формуле (1.10). Так как направления Ox, Oy и Oz вследствие хаотичности движения молекул равноправны, средние значения квадратов проекций скорости равны друг другу:
т.е. средний квадрат проекции скорости равен 1/3 среднего квадрата самой скорости. Множитель 1/3 появляется вследствие трехмерности пространства и, соответственно, существования трех проекций у любого вектора. Домашнее задание: 1. Изучить материал и сделать конспект по данной теме. (предоставлять конспект не нужно). 2. Составить 3 ребуса по данной теме. Ребусы присылаете мне на электронный адрес. (оформляем красиво, можно в тетради, ребусы из интернета не считаются) 3. Дома проделать любой опыта по данной теме, которые бы доказывали основные положения молекулярно-кинетической теории. Фотографии и их описание или видео присылаете мне на электронный адрес. Отправляете проделанную работу на электронный адрес lenr89@mail.ru, не забываем подписать группу и ФИО. | |
| Просмотров: 70 | Загрузок: 0 | | |
| Всего комментариев: 0 | |






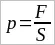 . Давление выражается в паскалях или миллиметрах ртутного столба: 1 Па = 1 Н/м² = 7,5 · 10–³ мм рт. ст.) Но как возникает это давление? Каждая молекула газа, ударяясь о стенку, в течение малого промежутка времени действует на нее с определенной силой. В результате беспорядочных ударов о стенку сила, действующая со стороны всех молекул на единицу площади стенки, т. е. давление, будет быстро меняться со временем примерно так, как показано на рисунке 18. Однако действия, вызванные ударами отдельных молекул, настолько слабы, что манометром они не регистрируются. Манометр фиксирует среднюю по времени силу, действующую на каждую единицу площади его чувствительного элемента – мембраны. Несмотря на небольшие изменения давления, среднее значение давления p0 практически оказывается вполне определенной величиной, так как ударов о стенку очень много, а массы молекул очень малы.
. Давление выражается в паскалях или миллиметрах ртутного столба: 1 Па = 1 Н/м² = 7,5 · 10–³ мм рт. ст.) Но как возникает это давление? Каждая молекула газа, ударяясь о стенку, в течение малого промежутка времени действует на нее с определенной силой. В результате беспорядочных ударов о стенку сила, действующая со стороны всех молекул на единицу площади стенки, т. е. давление, будет быстро меняться со временем примерно так, как показано на рисунке 18. Однако действия, вызванные ударами отдельных молекул, настолько слабы, что манометром они не регистрируются. Манометр фиксирует среднюю по времени силу, действующую на каждую единицу площади его чувствительного элемента – мембраны. Несмотря на небольшие изменения давления, среднее значение давления p0 практически оказывается вполне определенной величиной, так как ударов о стенку очень много, а массы молекул очень малы.