| Главная » Файлы » Дистанционное обучение » Теплотехники 1 курс |
| 27.11.2020, 14:15 | |
"Газовые законы. Уравнение состояния идеального газа" Процессы, при которых один из параметров состояния газа остается постоянным называют изопроцессами. Газовые законы – это законы, описывающие изопроцессы в идеальном газе. Газовые законы были открыты экспериментально, но все они могут быть получены из уравнения Менделеева-Клапейрона. Рассмотрим каждый из них. Закон Бойля-Мариотта (изотермический процесс)Изотермическим процессомназывают изменение состояния газа, при котором его температура остаётся постоянной. Для неизменной массы газа при постоянной температуре произведение давления газа на объем есть величина постоянная:
Этот же закон можно переписать в другом виде (для двух состояний идеального газа):
Этот закон следует из уравнения Менделеева – Клапейрона:
Очевидно, что при неизменной массе газа и при постоянной температуре правая часть уравнения остается постоянной величиной. Графики зависимости параметров газа при постоянной температуре называются изотермами. Обозначив константу буквой k1, запишем функциональную зависимость давления от объема при изотермическом процессе:
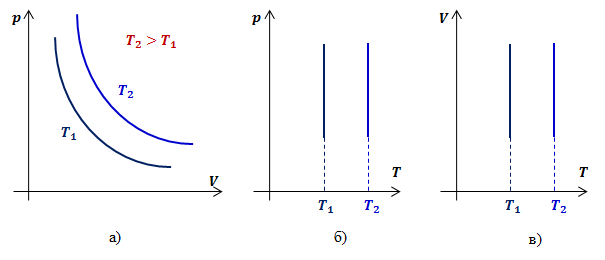
Видно, что давление газа обратно пропорционально его объему. Графиком обратной пропорциональности, а, следовательно, и графиком изотермы в координатах P,V является гипербола (рис.1, а). На рис.1 б) и в) представлены изотермы в координатах P,T и V,T соответственно.
Рис.1. Графики изотермических процессов в различных координатах Закон Гей-Люссака (изобарный процесс)Изобарным процессомназывают изменение состояния газа, при котором его давление остаётся постоянным. Для неизменной массы газа при постоянном давлении отношение объема газа к температуре есть величина постоянная:
Для двух состояний газа этот закон запишется в виде:
Этот закон также следует из уравнения Менделеева – Клапейрона:
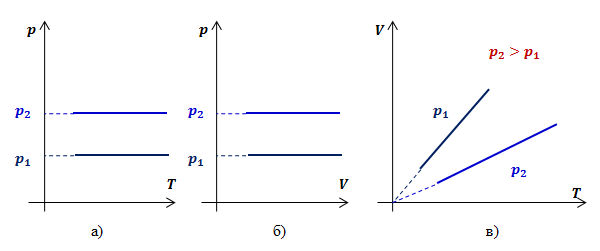
Графики зависимости параметров газа при постоянном давлении называются изобарами. Рассмотрим два изобарных процесса с давлениями p1 и p2(p2>p1). В координатах p,T и p,V изобары будут иметь вид прямых линий, перпендикулярных оси p (рис.2 а,б). Определим вид графика в координатах V,T.Обозначив константу буквой k2, запишем функциональную зависимость объема от температуры при изобарном процессе:
Видно, что при постоянном давлении объем газа прямо пропорционален его температуре. Графиком прямой пропорциональности, а, следовательно, и графиком изобары в координатах V,T является прямая, проходящая через начало координат (рис.2, в). В реальности при достаточно низких температурах все газы превращаются в жидкости, к которым газовые законы уже неприменимы. Поэтому вблизи начала координат изобары на рис.2, в) показаны пунктиром.
Рис.2. Графики изобарных процессов в различных координатах Закон Шарля (изохорный процесс)Изохорным процессомназывают изменение состояния газа, при котором его объем остаётся постоянным. Для неизменной массы газа при постоянном объеме отношение давления газа к его температуре есть величина постоянная:
Для двух состояний газа этот закон запишется в виде:
Этот закон также можно получить из уравнения Менделеева – Клапейрона:
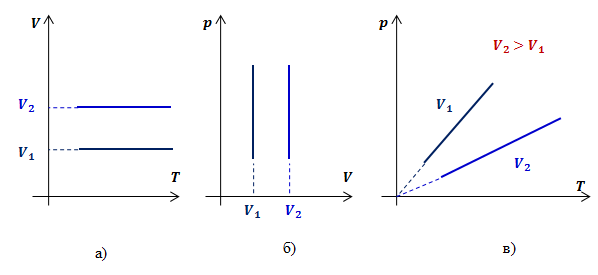
Графики зависимости параметров газа при постоянном давлении называются изохорами. Рассмотрим два изохорных процесса с объемами V1 и V2(V2>V1). В координатах V,T и p,V графиками изохор будут прямые, перпендикулярные оси V (рис.3 а, б). Для определения вида графика изохорного процесса в координатах p,T обозначим константу в законе Шарля буквой k3, получим:
Таким образом, функциональная зависимость давления от температуры при постоянном объеме является прямой пропорциональностью, графиком такой зависимости является прямая, проходящая через начало координат (рис.3, в).
Рис.3. Графики изохорных процессов в различных координатах Примеры решения задач можно рассмотреть, если скачать файл: "Примеры решения задач" Домашнее задание:1. Рассмотреть тему, составить конспект (на почту его можно не присылать). 2. Решете задачи используя формулы и законы из материала занятия:
Отправляете проделанную работу на электронный адрес lenr89@mail.ru, не забываем подписать группу и ФИО. | |
| Просмотров: 42 | Загрузок: 0 | | |
| Всего комментариев: 0 | |